Postdoc Boris Shneyer geeft update over zijn onderzoek naar Lama2-RD
Postdoctoraal onderzoeker Boris Shneyer vertelt over de recente ontwikkelingen in zijn onderzoek naar Lama2-RD, de stappen die zijn gezet en de perspectieven die dit biedt voor patiënten met deze zeldzame, erfelijke spierziekte. Dankzij steun van Stichting Voor Sara en het Prinses Beatrix Spierfonds werkt hij aan een innovatieve stamceltherapie op basis van patiëntmateriaal.
English version below.
De onderzoeksgroep van prof. dr. Bert Smeets zet zich in voor het ontwikkelen van een stamceltherapie op basis van patiëntmateriaal voor zeldzame, erfelijke spierziekten. Als postdoctoraal onderzoeker binnen deze groep richt ik mij op LAMA2-gerelateerde spierdystrofie (LAMA2-RD), een ernstige spierziekte. Dankzij de steun van de Stichting Voor Sara en het Prinses Beatrix Spierfonds kan ik twee jaar lang onderzoek doen naar een nieuwe behandelmethode voor LAMA2-RD-patiënten met een mutatie in het LAMA2-gen, die in Nederland relatief vaak voorkomt.
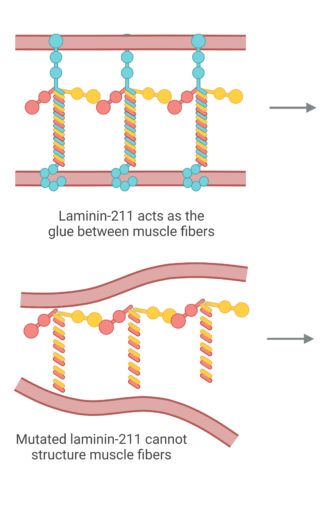
In Nederland heeft ongeveer één op de drie LAMA2-RD-patiënten dezelfde mutatie in één of beide kopieën van het LAMA2-gen. Deze zogeheten ‘founder mutatie’ komt voort uit een gezamenlijke voorouder. De mutatie zorgt ervoor dat het lichaam drie verschillende vormen van het LAMA2-eiwit aanmaakt: één iets kortere versie en twee sterk verkorte, niet-functionele versies. Patiënten met deze founder mutatie hebben doorgaans mildere klachten dan patiënten zonder functioneel LAMA2-eiwit. Dat suggereert dat het kortere eiwit deels functioneel is – en dat het verhogen van de hoeveelheid van dit eiwit mogelijk een therapeutisch effect kan hebben.
 De eerste stap is om te bevestigen dat dit kortere eiwit inderdaad functioneel is. Uit bestaande onderzoeken blijkt dat er LAMA2-eiwit aanwezig is in spierbiopten van patiënten met de founder mutatie, wat een positief teken is. Wij willen deze bevindingen verder onderzoeken door de hoeveelheid LAMA2-eiwit te meten in spier- en huidbiopten en in cellen van patiënten, en deze te vergelijken met gezonde controles. Ook willen we de gemeten eiwitniveaus koppelen aan de ernst van de ziekteverschijnselen. We verwachten dat patiënten met meer LAMA2-eiwit minder ernstige klachten hebben.
De eerste stap is om te bevestigen dat dit kortere eiwit inderdaad functioneel is. Uit bestaande onderzoeken blijkt dat er LAMA2-eiwit aanwezig is in spierbiopten van patiënten met de founder mutatie, wat een positief teken is. Wij willen deze bevindingen verder onderzoeken door de hoeveelheid LAMA2-eiwit te meten in spier- en huidbiopten en in cellen van patiënten, en deze te vergelijken met gezonde controles. Ook willen we de gemeten eiwitniveaus koppelen aan de ernst van de ziekteverschijnselen. We verwachten dat patiënten met meer LAMA2-eiwit minder ernstige klachten hebben.
Klinische studie
Om deze gegevens te verzamelen, hebben we een klinische studie ingediend om bestaande biopten en cellen te analyseren. Daarnaast bereiden we nieuwe studies voor, waaronder een onderzoek waarbij huidbiopten worden verzameld. Dat is minder belastend voor patiënten en bovendien beter geschikt om LAMA2-eiwit te meten dan spierbiopten.
De volgende stap is het verhogen van de hoeveelheid van het kortere LAMA2-eiwit. Daarvoor testen we een nieuwe behandeling: antisense oligonucleotide (ASO) therapie. Dit zijn kleine moleculen die het proces van eiwitproductie in cellen kunnen beïnvloeden. Zo kunnen ze helpen om de hoeveelheid van het kortere, functionele LAMA2-eiwit te vergroten.
Uit onze eerste testen blijkt dat ASO-therapie inderdaad leidt tot hogere niveaus van het kortere LAMA2-eiwit, dat het effect minstens twee weken aanhoudt en behouden blijft wanneer spiercellen zich ontwikkelen tot spiervezels. Dat is een belangrijke stap richting bewijs dat deze behandeling kan werken.
ASO-therapie testen
We bereiden nu een derde studie voor waarin we spiercellen van meer patiënten met de founder mutatie verzamelen. Zo kunnen we de ASO-therapie verder testen in patiëntcellen.
Mijn werk combineert genetische technieken en innovatieve behandelstrategieën – met als doel patiënten met LAMA2-RD dichter bij een effectieve behandeling te brengen.
Postdoc Boris Shneyer provides an update on his research into LAMA2-RD
Postdoctoral researcher Boris Shneyer shares the latest developments in his research on LAMA2-RD, the progress made so far, and the perspectives this offers for patients affected by this rare, inherited muscle disease. Thanks to the support of Stichting Voor Sara and the Prinses Beatrix Spierfonds, he is working on an innovative stem cell therapy based on patient-derived material.
The research group of Prof. Dr. Bert Smeets is committed to develop and produce a patient-derived stem-cell-based therapy for rare, genetic muscle diseases. As a postdoctoral researcher in the group, my work focuses on LAMA2-related dystrophy (LAMA2-RD), a severe muscular dystrophy. Thanks to the support of the Voor Sara Foundation and the Prinses Beatrix Spierfonds, I am able to carry out a two-year research project aimed at developing a novel therapy for LAMA2-RD patients carrying a LAMA2 mutation, which is common in the Netherlands.
In the Netherlands, about 1/3 of the LAMA2-RD patients have the same mutation in one or both copies of the LAMA2-gene. This mutation has the same ancestry and is called a founder mutation. This mutation in the LAMA2 gene causes the body to make three different versions of the LAMA2 protein, one of which is only slightly shorter, the other 2 are truncated, non-functional proteins. LAMA2 related muscular dystrophy (LAMA2-RD) patients with the founder mutation are less severly affected than the patients with no functional LAMA2 protein, which suggests that the shorter LAMA2 protein may be partially functional. This means that increasing the amount of this protein could bring therapeutic benefits.

Boris Shneyer (left) and Bert Smeets.
The first step is to make sure that the shorter protein is indeed functional. Limited data from literature shows the presence of LAMA2-protein in muscle biopsies of patients with the founder mutation, which is encouraging. In order to quantify these observations, we will measure the levels of the LAMA2 protein in biopsies (muscle and skin) and patient cells, compare them with controls and relate them to the clinical symptoms. We expect to see that patients with higher LAMA2 protein levels have fewer symptoms.
We have built and optimized the workflow needed for these measurements. To be able to collect this data, we have submitted a clinical study for approval to analyze biopsies and cells that were taken in the past. We are also submitting other clinical studies. One study aims to collect skin biopsies to measure LAMA2 protein levels. Skin biopsies have advantages over muscle biopsies – it is easier to measure LAMA2 protein levels in them and they are much less invasive than muscle biopsies.
The next step is to increase the amount of the shorter protein. We are testing a new treatment called antisense oligonucleotide (ASO) therapy. ASOs are small molecules that can change the way cells make proteins and can be used to increase the amount of the shorter LAMA2 protein. To test this therapy, we use muscle stem cells from LAMA2MD patients, which carry the founder mutation.
We found that indeed ASO treatment increases the levels of the shorter LAMA2 protein, that its effect lasts for at least two weeks and that the effect persists when muscle cells fuse into muscle fibers. This is an important step in confirming that the treatment can work.
A third study is being prepared to collect muscle cells from more patients with the founder mutation, which will allow further testing of the ASO therapy in patient cells. My work combines genetic tools and innovative therapeutic strategies to bring us closer to effective treatment options for patients.